Hello, Welcome back to my blog 💋
/>
I.
PENDAHULUAN
A. Judul
Spektrofotometri
B. Tujuan
1. Menentukan
panjang gelombang optimum suatu zat
2. Membuat
kurva standar hubungan kadar dan absorbansi
II.
TINJAUAN PUSTAKA
Spektroskopi
merupakan ilmu yang mempelajari materi dan atributnya berdasarkan cahaya, suara
atau partikel yang dipancarkan, diserap, dipantulkan oleh materi tersebut.
Spektroskopi merupakan metode yang mempelajari interaksi antara cahaya dan materi. Dalam spektroskopi cahaya tampak
digunakan dalam teori-teori struktur
materi dalam struktur kimia analisa kualitatif dan analisa kuantitatif.
Perkembangan zaman yang modern ini, spektroskopi tidak hanya memanfaatkan cahaya
tampak tapi juga bentuk lain dari radiasi gelombang elektromagnetik dan non
elektromagnetik seperti gelombang mikro, gelombang radio, gelombang elektron,
gelombang fenon, gelombang suara dan sinar X. Spektroskopi biasanya digunakan
dalam kimia fisik dan analisis untuk identifikasi substansi melalaui spektrum
yang dipancarkan (Day dan Underwood, 1996).
Berdasarkan sinyal
radiasi elektromagnetik, spektroskopi dibagi menjadi empat golongan yaitu
spektroskopi absorpsi, spektroskopi emisi, spektroskopi scattering, dan
spektroskopi fluoresensi. Pada spektroskopi absorpsi, terdapat beberapa tipe
metode spektroskopi berdasarkan sifat radiasinya, yaitu spektroskopi absorpsi
atom (nyala), absorpsi atom (tanpa nyala) dan absorpsi sinar-x. Pada
spektroskopi emisi, terdapat beberapa tipe metode spektroskopi yaitu arc spark,
plasma argon, emisi atom atau emisi nyala dan emisi sinar-x (Sastrohamidjojo,
1985).
Spektrofotometri
merupakan suatu metode analisa yang didasarkan pada pengukuran serapan sinar
monokromatis oleh suatu lajur larutan berwarna pada panjang gelombang spesifik
dengan menggunakan monokromator prisma atau kisi difraksi dengan detektor fototube. Spektrofotometri dapat
dianggap sebagai perluasan suatu pemeriksaan visual dengan studi yang lebih
mendalam dari absorbsi energi. Absorbsi radiasi oleh suatu sampel diukur pada
berbagai panjang gelombang dan dialirkan oleh suatu perkam untuk menghasilkan
spektrum tertentu yang khas untuk komponen yang berbeda (Khopkar, 2003).
Spektrofotometer
sesuai dengan namanya adalah alat yang terdiri dari spektrometer dan fotometer.
Spektrometer menghasilkan sinar dari spektrum dengan panjang gelombang tertentu
dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau yang
diabsorbsi. Jadi spektrometer digunakan untuk mengukur energi secara relatif
jika energi tersebut ditransmisikan, direfleksikan atau diemisikan sebagai
fungsi dari panjang gelombang. Kelebihan spektrofotometer dibandingkan
fotometer adalah panjang gelombang dari sinar putih dapat lebih terseleksi dan
ini diperoleh dengan alat pengurai seperti prisma, grating ataupun celah optis
(Khopkar, 2003).
Prinsip kerja
spektrofotometer adalah bila cahaya (monokromatik maupun campuran) jatuh pada
suatu medium homogen, sebagian dari sinar masuk akan dipantulkan, sebagian
diserap dalam medium itu, dan sisanya diteruskan. Nilai yang keluar dari cahaya
yang diteruskan dinayatakan dalam nilai absorbansi karena memiliki hubungan
dengan konsentrasi sampe (Sutopo, 2006).
Menurut Sirait
(2009), spektrofotometer memiliki jenis yang berbeda – beda. Jenis – jenis
tersebut dibedakan berdasarkan teknik optik standar dan daerah spektrum yang
akan dieksplorasi. Berdasarkan teknik optika standar sebagai berikut:
1. Spektrofotometer
optika sinar tunggal (single beams optik)
Cahaya
hanya melewati satu arah sehingga nilai yang diperoleh hanya nilai abserbansi
dari larutan yang dimasukan. Dapat digunakan untuk kuantitatif dengan mengukur
absorbansi pada panjang gelombang tunggal. Semua cahaya melewati seluruh sel
sampel. Contoh alat spektrofotometer single beam adalah spektronik 20. Alat ini
merupakan desain paling awal tetapi masih bayak digunakan baik dalam pengajaran
maupun laboratotium industri. Ada beberapa keuntungan dari spektrofotometer ini
yaitu, sederhana, harganya murah, mengurangi biaya yang ada mereupakan
keuntungan nyata. Panjang gelombang paling rendah adalah 190 sampai 210 nm dan
paling tinggi 800 sampai 1000 nm.
2. Spektrofotometer
optika sinar ganda (double beams optic)
Cahaya
terbagi ke dalam dua arahatau berkas. Berkas cahaya pertama melewati sel cahaya
pembanding, dan cahaya yang lain melewati sel sampel. Berkas cahaya kemudian
bergabung kembali, masuk ke detektor. Detektor merespon cahaya netto ke dua
arah. Beberapa alat double beam memiliki dua detector, sampel dan sinar diukur
pada waktu yang sama. Nilai blanko dapat langsung diukur dengan larutan yang
diinginkan dala satu kali proses yang sama. Digunakan pada panjang gelombang
190 sampai 750 nm. Mempunyai dua sinar yang dibentuk oleh potongan cermin yang
berbentuk V yang disebut pemecah sinar. Sinar pertama melewati larutan blanko
dan sinar kedua secara serentak melewati sampel, mencocokan foto detektor yang
keluar menjelaskan perbandingan yang ditetapkan sacara elektronik dan
ditunjukkan oleh pembaca.
Berdasarkan daerah spectrum yang akan
dieksplorasi adalah sebagai berikut:
1. Spektrofotometer
ultraviolet (UV)
Spektrofotometri
UV berdasarkan interkasi sampel dan sinar UV. Sianr UV memiliki panjang
gelombang 190 – 380 nm. Sebagai sumber sinar dapat digunakan lampu deuterium.
Deuterium disebut juga heavy hidrogen. Dia merupakan isotop hydrogen yang
stabil yang berlimpah dilaut dan daratan. Karena sinar UV tidak dapat dideteksi
oleh mata manusia maka senyawa yang dapat menyerap sinar ini terkadang
merupakan senyawa yang tidak memiliki warna bening dan transparan.
2. Spektrofotometer
sinar tampak (VIS)
Sumber cahaya yang
digunakan adalah lampu tungsten halogen atau sering disebut wolfram. Lampu
tungsten halogen manghasilkan cahaya tampak dalam daerah panjang gelombang 350
– 800 nm. Lampu tersebut terbuat dari tabung kuarsa yang berisi filamen
tungsten dan sejumlah kecil iodine. Lampu ini mirip dengan lampu yang terdapat
dalam perumahan dan perkantoran.
3. Spektrofotometer
infra merah (IR)
Spektrofotometer
ini berdasar kepada penyerapan panjang gelombang inframerah. Cahaya inframerah
terbagi menjadi inframerah dekat, pertengahan, dan jauh. Inframerah pada
spektrofotometer adalah inframera jauh dan pertengahan yang mempunyai panjang
gelombang 2,5 – 1000 mikrometer. Hasil analisa biasanya berupa signal
kromatogram hubungan intensitas IR terhadap panjang gelombang. Untuk
identifikasi, signal sampel akan dibandingkan dengan signal standard.
4. Spektrofotometer
serapan atom (UV – VIS)
Sumber
cahaya yang digunakan adlah kombinasi antara lampten halogen dan tungsten
halogen dan deuterium (D2). Lampu deuterium (D2)dapat menghasilkan cahaya dalam
daerah 160 – 380 nm.
Hukum yang
mendasari spektrofotometri yaitu hukum Lambert-Beer. Hukum Lambert menyatakan
bahwa proporsi berkas cahaya yang diserap oleh suatu bahan tidak bergantung
pada intensitas berkas cahaya yang datang.namun hal tersebut berlaku jika dalam
bahan tidak tidak terjadi reaksi kimia.Sedangkan Hukum Beer menyatakan bahwa
absorbansi cahya berbanding lurus dengan konsentrasi dan ketebalan bahan atau
medium.
A = Є.c.l
Є = molar absortivitas untuk panjang gelombang
tertentu.
Kombinasi dari
kedua hukum ini menghasilkan Hukum Lambert – Beer, yaitu:
%T = (I/I0)
x 100 = exp (- Є.c.l)
A = Log(I/I0) = Є.c.l
Sesuai dengan hukum Lambert – Beer,
absorbansi berbanding lurus dengan konsentrasi, jika konsentrasi tinggi maka
absorbansi juga semakin tinggi. Hubungan kepekatan warna dengan konsentrasi,
dimana semakin tinggi konsentrasi, maka warna juga semakin pekat. Oleh karena
itu semakin pekat suatu warna larutan, maka absorbansinya juga akan semakin
tinggi (Khopkar, 2003).
Menurut Devita
(2013), senyawa – senyawa yang dapat diukur dengan metode ini harus memenuhi
hukum Lambert – Beer yaitu:
1. Bila
suatu sinar monokromatis dilewatkan pada medium pengabsorbsi, maka berkurangnya
intensitas cahaya per unit tebal medium sebanding dengan intensitas cahaya
tersebut.
2. Berkurangnya
intensitas cahaya per unit konsentrasi akan berbanding lurus dengan intensitas
cahaya.
Menurut Khopkar (1990), suatu
spektrofotometer terdiri dari:
1.
Sumber
cahaya, sebagai sumber cahaya pada spektrofotometer harus memiliki pancaran
radiasi yang stabil dan intensitasnya tinggi. Sumber yang biasa digunakan
adalah lampu wolfram dengan
panjang gelombang (λ) di atas 375 nm atau lampu detrium (D2) yang memiliki
panjang gelombang (λ) di bawah 375 nm. Berfungsi untuk memperoleh
tegangan yang stabil dan digunakan
transformator.
2.
Monokromator, merupakan
alat yang berfungsi untuk menguraikan cahaya polikromatis menjadi beberapa
komponen panjang gelombang tertentu (monokromatis) yang berbeda. Alatnya dapat berupa prisma ataupun grating. Untuk
menguraikan sinar monokromatis yang diinginkan dari hasil penguraian ini
digunakan celah.
3.
Cuvet, merupakan suatu alat yang digunakan sebagai
tempat contoh atau cuplikan yang akan dianalisis. Cuvet biasanya terbuat dari
kuarsa, plexigalass, kaca, plastic dengan bentuk yabung empat persegi panjang 1
x 1 cm dan tinggi 5 cm.
4.
Detektor, peranannya memberi respon terhadap cahaya
pada berbagai panjang gelombang. Detektor akan mengubah cahaya menjadi sinyal
listrik yang selanjutnya akan ditampilkan oleh peampil data dalam bentuk jarum penunjuk
atau angka digital.
Metode
deret standar dilakukan dengan membuat suatu deret larutan standar zat yang
akan diketahui konsentrasinya dengan berbagai macam variasi konsentrasi.
Kemudian larutan sampel dibandingkan dengan deret yang ada. Larutan dengan
warna yang serupa secara eksak dengan standar memiliki konsentrasi sama dengan
konsentrasi standar (Fatimah, 2009). Pada metode analisa deret standar, tabung
– tabung seragam yang tidak berwarna dengan dasar datar (disebut tabung
Nessler) digunakan untuk menampung larutan berwarna dengan jumlah volume
tertentu. Warna ini kemudian dibandingkan dengan larutan standar yang dibuat
dari komponen yang sama dengan yang dianalisis tetapi konsentrasinya telah
diketahui (Khopkar, 2003).
Larutan
standar adalah larutan yang mengandung suatu zat dengan berat ekuivalen
tertentu dalam volume tertentu, larutan standar disiapkan dengan menimbang
reagen murni secara tepat, karena tidak semua standar tersedia dalam keadaan
murni. Larutan standar berfungsi membakukan atau memastikan konsentrasi suatu
larutan, yaitu suatu larutan atau pereaksi yang ketetapan konsentrasinya sukar
yang diperoleh pembuatannya secara langsung (Suhatono, 1989).
Larutan
blanko adalah pelarut sebelum ditambahkan kompleks warna atau suatu larutan
yang tidak menyerap atau pelarut yang belum ditambahkan kompleks berwarna.
Larutan blanko yang digunakan adalah aquades. Aquades digunakan karena aquades
tidak berwarna atau bening sehingga tidak menimbulkan energi pantul pada
spektrofotometer yang menyebabkan gelombang yang diukur 0 nm (Khopkar, 2003).
Fungsi larutan blanko:
1.
Sebagai larutan
pembanding untuk mengukur intensitas cahaya, menghamburkan cahaya, dan tidak
menyerap cahaya.
2.
Aquades harus 0 nm karena
fungsinya sebagai penyangga, larutan yang ditambahkan aquades semakin kecil
konsentrasinya semakin kecil absorbansinya.
3.
Mengkoreksi absorbansi
atau senyawa yang akan diteliti dengan metode spektrofotometri sehingga tidak
terjadi kesalahan pembacaan oleh alat.
Menurut Day dan
Underwood (1989), larutan cuplikan merupakan larutan sampel yang ditambahkan
kompleks berwarna kedalamnya sehingga dapat dianalisa menggunakan
spektrofotometer. Hasil absorbansinya akan dibandingkan dengan nilai larutan
standar. Konsentrasi larutan cuplikan dapat dari rumus perhitungan ataupun dari
kurva standar.
Umumnya pelarut
yang sering digunakan dalam analisis
sektrofotometri UV-Vis adalah air, etanol, sikloheksan, dan isopropanol.
Namun demikian perlu diperhatikan absorpsi pelarut yang dipakai pada daerah
UV-Vis (penggal UV = UV cut off) (Mulja dan Suharman, 1995).
Pada praktikum ini digunakan larutan NH4Fe(SO4)2Cl
+ HCl berfungsi sabagai larutan standar dan berfungsi juga sebagai larutan
cuplikan. Larutan KCNS 10% yang berfungsi untuk memberikan intensitas warna
yang tampak, selain itu dapat memberikan warna merah pada larutan standar. Larutan
KCNS 10 % yang ditambahkan ini pun akan membentuk warna merah dengan reaksi :
1. Penambahan KCNS 10 % (terbentuk ion Fe)
Fe3+ + 6 CNS  (FeCNS)6
(FeCNS)6
2. Penambahan aquadest
Fe3+ + H2O Fe(OH)3 + 3 H
Pada analisis secara spektrofotometri
terdapat tiga daerah panjang gelombang elektromagnetik yang
digunakan, yaitu:
1. Daerah
UV ;λ = 200 – 380 nm
2. Daerah
visible (tampak);λ = 380 – 700 nm
3. Daerah
inframerah (IR);λ = 700 – 0,3µ
Pada percobaan, panjang gelombang (l)
yang digunakan yaitu 475 nm pada panjang gelombang tersebut larutan dapat
melakukan serapan maksimum. Panjang gelombang harus pada serapan maksimum
karena perubahan absorbansi dengan berubahnya konsentrasi akan lebih cepat dan
sensitif.
III.
METODE
A. Alat
dan Bahan
Pada
praktikum kali ini alat yang digunakan adalah pro pipet, pipet ukur, tabung
reaksi, rak tabung reaksi, labu ukur, spektrofotometer, kuvet, dan tissue. Bahan
yang digunakan adalah larutan NH4Fe(SO4)2,
KCNS 10%, Akuades, dan larutan cuplikan.
B. Cara
Kerja
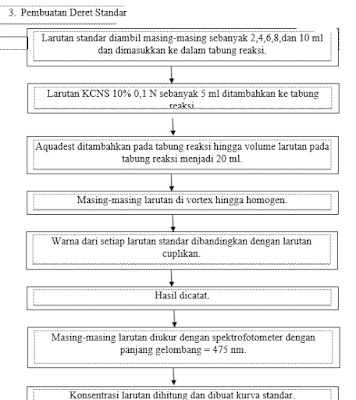
1. Pembuatan Larutan Standar
IV.
HASIL DAN PEMBAHASAN
A. Hasil
Berdasarkan hasil
praktikum diperoleh jasil sebagai berikut:
Tabel 1. Hasil Pengukuran
Absorbansi Deret Standar
Larutan
Standar (m1)
|
Absorbansi
(Å)
|
2
|
0,137
|
4
|
0,281
|
6
|
0,444
|
8
|
0,586
|
10
|
0,757
|
Tabel
2. Hasil Pengukuran Absorbansi Larutan Blanko dan Larutan Cuplikan
Larutan
|
Absorbansi (Å)
|
Blanko
|
0
|
Cuplikan x
|
0,270
|
Cuplikan y
|
0,473
|
B. Pembahasan
Spektrofotometer
sesuai dengan namanya adalah alat yang terdiri dari spektrometer dan fotometer.
Spektrometer menghasilkan sinar dari spektrum dengan panjang gelombang tertentu
dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau
yang diabsorbsi. Jadi spektrometer digunakan untuk mengukur energi secara
relatif jika energi tersebut ditransmisikan, direfleksikan atau diemisikan
sebagai fungsi dari panjang gelombang. Kelebihan spektrofotometer dibandingkan
fotometer adalah panjang gelombang dari sinar putih dapat lebih terseleksi dan
ini diperoleh dengan alat pengurai seperti prisma, grating ataupun celah optis
(Khopkar, 2003).
Prinsip
kerja spektrofotometer adalah bila cahaya (monokromatik maupun campuran) jatuh
pada suatu medium homogen, sebagian dari sinar masuk akan dipantulkan, sebagian
diserap dalam medium itu, dan sisanya diteruskan. Nilai yang keluar dari cahaya
yang diteruskan dinayatakan dalam nilai absorbansi karena memiliki hubungan
dengan konsentrasi sampe (Sutopo, 2006).
Pada
praktikum ini spektrofotometer yang digunakan adalah spektrofotometer UV –
Visible dengan merk G10S UV – VIS spectrofotometer.
Komponen
dari spektrofotometri UV – VIS:
1. Sumber energi cahaya dapat di-pakai lampu Wolfram yang
meng-hasilkan sinar dengan λ di atas 375 nm atau lampu detrium (D2) yang
memiliki λ di bawah 375 nm.
2. Monokromator: suatu piranti untuk mengecilkan
panjang-panjang gelombang dari spektrum
lebar yang dipancarkan oleh sumber cahaya. .
3. Wadah sampel (kuvet): untuk tempat/wadah larutan
saat larutan akan diukur di dalam spektrofotometer.
4. Detektor: yang berupa transduser yang mengubah
energi cahaya menjadi suatu isyarat listrik.
5. Pengganda: dan rangkaian yang berkaitan membuat
isyarat listrik itu memadai untuk dibaca.
6. Sistem baca (piranti pembaca) yang memperagakan
besarnya isyarat listrik, menyatakan dalam bentuk % Transmitan (% T) maupun
Absorbansi (Ǻ).
Untuk menentukan absorbansi suatu zat, ada beberapa
larutan yang harus digunakan antara lain larutan standar, larutan blanko, dan
larutan cuplikan. Larutan standar adalah suatu larutan yang konsentrasinya diketahui secara
pasti yang berfungsi membakukan atau memastikan konsentrasi suatu larutan,
yaitu suatu larutan atau pereaksi yang ketetapan konsentrasinya sukar yang
diperoleh pembuatannya secara langsung. Larutan blanko adalah larutan yang
tidak menyerap atau pelarut yang belum ditambahkan kompleks warna. Larutan
blanko yang digunakan dalam percobaan ini adalah aquades. Fungsinya sebagai larutan pembanding
untuk mengukur intensitas cahaya, menghamburkan cahaya, dan tidak menyerap
cahaya dan mengoreksi
absorbansi suatu senyawa yang akan diteliti dengan metode spektrofotometer
sehingga kesalahan pembacaan oleh alat seminimal mungkin dapat ditekan. Larutan
cuplikan larutan yang
konsentrasinya belum diketahui secara pasti. Pada metode deret standar,
tabung-tabung seragam yang tidak berwarna dengan dasar datar (disebut tabung
Nessler) digunakan untuk menampung larutan cuplikan. Warna ini kemudian dibandingkan
dengan larutan standar yang dibuat dari komponen yang sama dengan yang
dianalisis tetapi konsentrasinya telah diketahui.
Analisa
deret standar bertujuan untuk membandingkan tingkat konsentrasi dan warna
larutan larutan standar dengan larutan cuplikan secara kasat mata. Ketiga
larutan ini diperlukan dalam menentukan absorbansi suatu zat karena, ketiga
larutan saling berkaitan untuk menetukan absorbansi.
Pada percobaan
spektroskopi ini, terdapat beberapa perlakuan yang digunakan. Perlakuan-perlakuan
itu adalah :
1. Penambahan
aquadest pada larutan NH4Fe(SO4)2 + HCl pada pembuatan larutan standar,
berfungsi untuk mengencerkan larutan NH4Fe(SO4)2 + HCl sehingga tidak terlalu
pekat.
2. Pembuatan
larutan blanko berfungsi sebagai pembanding larutan standar maupun larutan cuplikan.
3. Larutan
di vortex, berfungsi agar larutan yang ada didalam tabung reaksi dapat bercampur
secara sempurna.
4. Membandingkan
larutan standar dengan larutan cuplikan, berfungsi untuk mengetahui letak dari
larutan cuplikan pada larutan standar.
5. Peneraan
dengan spektrofotometer, berfungsi untuk mengetahui nilai absorbansi dari
larutan blanko, larutan standar dan larutan cuplikan.
Pada praktikum ini
digunakan larutan KCNS 10 % yang
berfungsi untuk memberikan intensitas warna yang tampak, selain itu dapat
memberikan warna merah pada larutan standar. Larutan KCNS 10 % yang ditambahkan
ini pun akan membentuk warna merah dengan reaksi :
1. Penambahan KCNS 10 % (terbentuk ion Fe)
Fe3+ + 6 CNS  (FeCNS)6
(FeCNS)6
2. Penambahan aquadest
Fe3+ + H2O  Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
Pada reaksi yang
pertama, KCNS yang ditambahkan bereaksi dengan ion Fe3+ yang
terkandung dalam NH4Fe(SO4)2. Dalam reaksi
antara KCNS dan ion Fe3+ terjadi reaksi bolak – balik yang
menghasilkan Fe(CNS)6. KCNS disebut sebagai reagen spesifik dari Fe
yang kemudian menyebabkan larutan berwarna merah. Pada reaksi kedua yaitu
proses penambahan aquades pada deret larutan standar. Reaksi ini melibatkan H2O
yang berfungsi untuk menghidrolisis ion Fe3+ sehingga CNS dapat
mengikat ion Fe3+ lebih baik dan larutan yang dihasilkan menjadi
lebih stabil.
Panjang
gelombang yang digunakan dalam percobaan ini adalah 475 nm yang dianggap sudah
optimum untuk melakukan uji absorbansi larutan sampel yang akan diuji dengan
mendapatkan hasil yang optimum.
. Percobaan dimulai dengan membuat larutan standar.
Larutan standar dibuat dari campuran NH4Fe(SO4)2
ditambah dengan HCl. Campuran tersebut diambil sebanyak 10 ml dan dimasukkan ke
dalam labu ukur 100 ml. Labu ukur digunakan sebagai alat untuk membantu
pengenceran campuran. Aquades ditambahkan hingga tanda batas. Aquades digunakan
sebagai pelarut polar NH4Fe(SO4)2 + HCl.
Setelah ditambah dengan aquades hingga tanda batas, larutan standar sudah siap
digunakan.
Larutan standar yang sudah dibuat tadi diambil 2, 4, 6,
8,dan 10 ml dan masing-masing diletakkan dalam 5 tabung berbeda. Kemudian
masing-masing dari tabung reaksi ditambahkan KCNS 10% sebanyak 5 ml. Fungsinya
adalah untuk menyamakan komponen kimiawi dalam larutan standar. Kemudian masing-masing tabung ditambahi aquades hingga
20 ml, penambahan volume aquades setiap tabung berbeda-beda. Setelah itu divortex agar
campuran menjadi homogen.
Larutan blanko
dibuat dengan tujuan sebagai larutan pembanding. Larutan blanko dibuat dari
campuran 10 ml aquades yang ditambah dengan KCNS 10%. Fungsi dari KCNS 10%
adalah sebagai pembentuk kompleks warna agar komponen sama dengan larutan. Kemudian
larutan blanko divorteks, tujuannya sebagai peng-homogen-an larutan (larutan
tercampur merata). Setelah itu larutan blanko siap digunakan.
Larutan
standar yang tadi sudah dibuat disebut dengan deret standar. Deret standar ini
kemudian dibandingkan dengan larutan cuplikan X dan Y. Tujuan dari proses
membandingkan ini adalah untuk memperkirakan konsentrasi larutan cuplikan
dengan larutan yang ada di deret standar,dengan cara membandingkan warna pada
deret standard an warna cuplikan.
Dari
percobaan yang dilakukan diperoleh hasil absorbansi standar 2 ml memiliki
absorbansi sebesar 0,137 Å dengan konsetrasi 0,01 N; larutan standar 4 ml
memiliki absorbansi sebesar 0,281 Å dengan konsetrasi 0,02 N; larutan standar 6
ml memiliki absorbansi sebesar 0,444 Å dengan konsetrasi 0,03 N; larutan
standar 8 ml memiliki absorbansi sebesar 0,586 Å dengan konsetrasi 0,04 N; dan
larutan standar 10 ml memiliki absorbansi sebesar 0,757 Å dengan konsetrasi
0,05 N. Dari hasil yang diperoleh diketahui bahwa semakin tinggi konsentrasi
larutan standar maka akan semakin tinggi absorbansi standarnya. Hal ini sesuai
dengan Hukum Lambert-Beer yang mengatakan bahwa absorbansi berbanding lurus
dengan konsentrasi, jika konsentrasi tinggi, absorbansi juga semakin tinggi.
Dari pengukuran
absorbansi larutan blanko dan larutan cuplikan X dan Y diperoleh hasil sebagai
berikut: larutan blanko memiliki absorbansi sebesar 0,000 Ǻ, larutan cuplikan X
memiliki absorbansi sebesar 0,270 Ǻ, dan larutan cuplikan Y memiliki absorbansi
sebesar 0,473 Ǻ. Dari peneraan dapat dilihat bahwa warna larutan cuplikan X
sama dengan warna dari larutan standar 4 ml yang memiliki konsentrasi
0,02 N dan warna larutan cuplikan Y sama dengan warna dari larutan
standar 6 ml yang memiliki konsentrasi 0,03 N. Berdasarkan grafik diperoleh
konsentrasi larutan cuplikan X adalah 0,0015 N, jika konsentrasi larutan
cuplikan X dibandingkan dengan konsentrasi pada larutan standar 4 ml yaitu 0,02
N hasilnya tidak jauh berbeda sehingga dapat dikatakan hasil tersebut sudah
cukup tepat. Konsentrasi larutan cuplikan Y adalah 0,035 N, jika konsentrasi
larutan cuplikan Y dibandingkan dengan konsentrasi pada larutan standar 6 ml
yaitu 0,03 N hasilnya tidak jauh berbeda sehingga dapat dikatakan hasil
tersebut sudah cukup tepat. Dari hasil perhitungan maupun hasil melalui grafik
standar, dapat diketahui bahwa semakin besar absorbansinya maka semakin besar
juga konsentrasinya sehingga dapat dikatakan absorbansi dan konsentrasi
berbanding lurus.
Pada
pengukuran menggunakan spektrofotometer ini sudah dikatakan akurat karena spektrofotometer
sangat sensitif terhadap larutan yang akan diukur absorbansinya.
V.
KESIMPULAN
Berdasarkan
percobaan yang dilakukan diambil kesimpulan sebagai berikut:
1. Hasil
absorbansi larutan standar dengan panjang gelombang yang digunakan 475 nm karena pada panjang gelombang ini
sesuai untuk melakukan serapan maksimum yang mendekati warna merah. Hasil yang
didapat adalah sebagai berikut :
a. Larutan
standar 2 ml dengan konsentrasi 0,001 N memiliki absorbansi 0,137 Ǻ.
b. Larutan
standar 4 ml dengan konsentrasi 0,002 N memiliki absorbansi 0,281 Ǻ.
c. Larutan
standar 6 ml dengan konsentrasi 0,003 N memiliki absorbansi 0,444 Ǻ.
d. Larutan
standar 8 ml dengan konsentrasi 0,004 N memiliki absorbansi 0,536 Ǻ.
e. Larutan
standar 10 ml dengan konsentrasi 0,005 N memiliki absorbansi 0,757 Ǻ.
f.
Larutan cuplikan X
memiliki absorbansi 0,270 Ǻ didapati pada grafik memiliki konsentrasi sekitar
0,015 N
g. Larutan
cuplikan B memiliki absorbansi 0,473 Ǻ didapati pada grafik memiliki
konsentrasi sekitar 0,035 N
2. Berdasarkan
kurva standar maka dapat diperoleh konsentrasi larutan cuplikan A menurut
grafik adalah 0,010 N sedangkan larutan cuplikan B berada pada konsentrasi 0,014 N
DAFTAR PUSTAKA
Day, R.A.
dan Underwood, A.L.. 1996. Analisis Kimia Kuantitatif. Erlangga, Jakarta.
Fatimah
S,2009. Pengaruh Uranium Terhadap Analisis Thorium Menggunakan Spektrofotometer
UV-Vis. Seminar Nasional V, ISSN
1978-0176. SDM Teknologi Nuklir Yogyakarta, 5 November 2013.
Khopkar,
S. M. 1990. Konsep Dasar Kimia Analitik.
UI-press, Jakarta.
Mulja,
H.M. dan Suharman. 1995. Analisis Instrumental. Airlangga University
Press, Surabaya.
Sastrohamidjojo,
H. 1985. Spektroskopi. Liberty,
Yogyakarta.
Sirait, R.
A. 2009. Penerapan Metode Spektrofotometri Ultraviolet pada Penetapan Nifedipin
dalam Sediaan Tablet. Skripsi.
Fakultas Farmasi Universitas Sumatra Utara, Medan.
Suhartono,
M. T. 1989. Petunjuk Laboratorium Dasar –
Dasar Biokimia. IPB, Bogor.
So, that's it.. semoga membantu..









No comments:
Post a Comment